研究の概要
三重大学大学院医学系研究科の谷一寿特任教授、溝口明教授、沖縄科学技術大学院大学のBruno Humbel博士、茨城大学大学院理工学研究科の大友征宇教授らのグループは、水田などの淡水に棲息する紅色細菌のRhodobacter capsulatus(ロドバクター・カプシュラタス)の「膜タンパク質コア光捕集反応中心複合体の立体構造」をクライオ電子顕微鏡(Cryo-EM)による可視化に成功しました。
コア光捕集反応中心複合体(LH1-RC)は、光合成細菌が太陽光エネルギーを集め、光から電子へ変換し、作り出した電子を渡す役割を担っている膜タンパク質です。これまで立体構造が報告されている紅色細菌のLH1-RCは、光捕集に特化したアンテナタンパク質であるLH1が反応中心RCをリング状に取り囲むように並ぶものばかりでした。アミノ酸配列や立体構造での比較からも、非常によく似ているにもかかわらず、このようなLH1サブニット数に違いが生じるメカニズムは、謎につつまれていました。
ロドバクター・カプシュラタスのコア光捕集反応中心複合体は、他の種とは異なり、LH1サブニット数が10個と最小構成数となっており、理論的には8個のサブニット数で光合成が可能であることを支持する結果となっています。さらに、近縁種であるロドバクター・スフェロイデスでは同じ単量体が二つ集まった二量体も形成できることが知られているのですが、本種ではその集合時のカギとなるPufXの形が大きく異なるうえ、2021年に発見した二量体を安定化するProtein-Uも存在しないことから、単量体として機能することが立体構造上からも明らかになりました。そのため二量体を形成することはなく、本当の意味で極小サイズの光合成ユニットであることを明らかにしました。
今回得られた立体構造から、光捕集複合体の進化的な謎であった最小構成数での機能ユニットを示唆することが可能となり、理論上LH1サブニット数が8個以上なら近赤外領域の吸収極大波長に大きな影響を及ぼさないこととも一致し、これらの特徴をうまく進化的に取り入れて効率的に生き残れる戦略を取っていることがわかりました。そのため本研究により、極小サイズの構成数でも高効率な太陽光エネルギー利用への貢献、環境保全への活用が期待されます。
三重大学、茨城大学、沖縄科学技術大学院大学、神戸大学、中国科学院植物研究所、南イリノイ大学の国際共同研究によるこの成果は、2023年2月15日、学術誌「Nature Communications」に掲載(https://www.nature.com/articles/s41467-023-36460-w)されました。
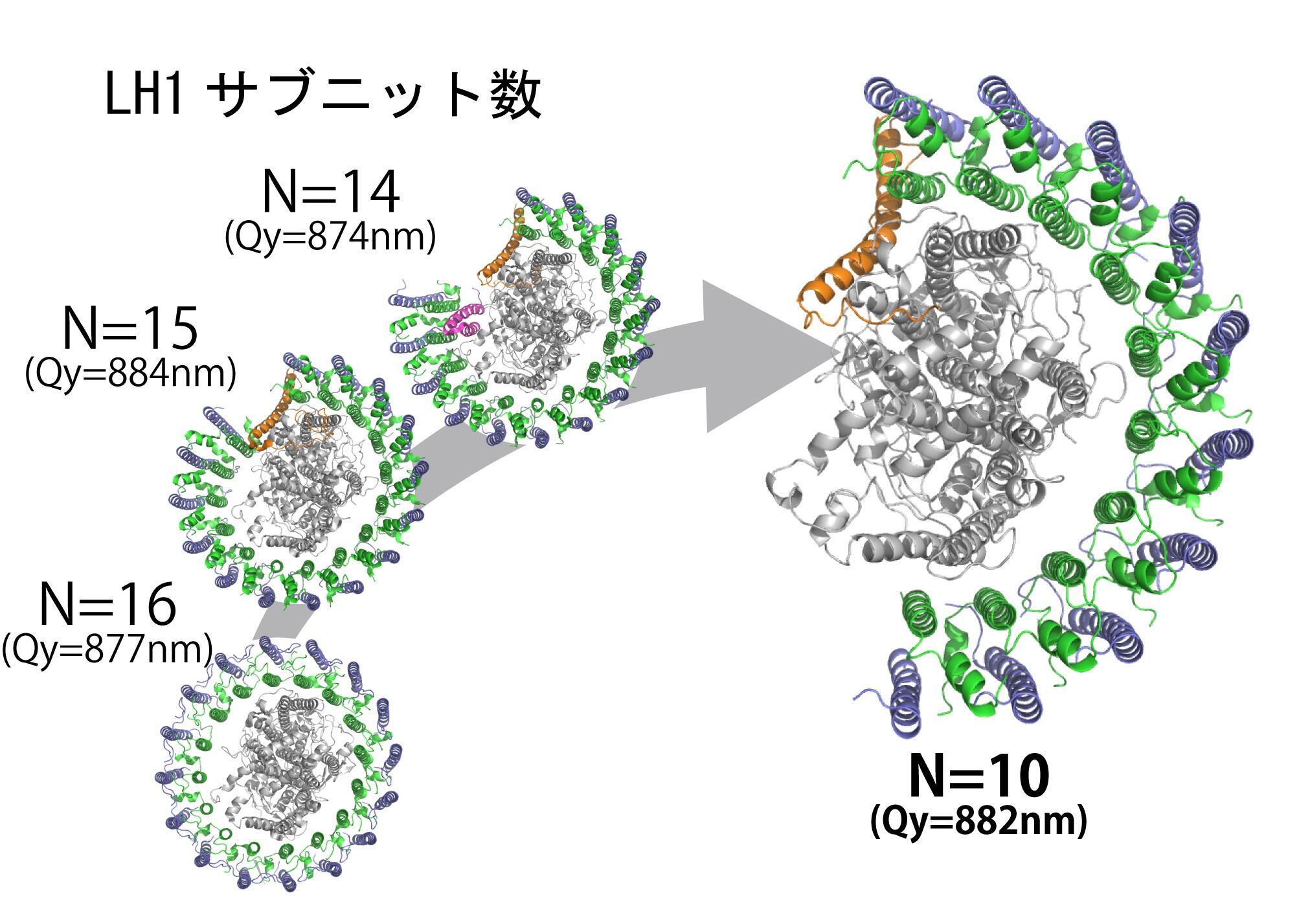
LH1 サブニット数の多様性とコア光捕集反応中心複合体
詳しくはこちらをご覧ください。
研究者情報
三重大学大学院医学系研究科 特任教授
谷 一寿(Kazutoshi Tani)
専門分野:構造生物学
三重大学大学院医学系研究科 教授
溝口 明(Akira Mizoguchi)
専門分野:電子顕微鏡(解剖学)
沖縄科学技術大学院大学 電子顕微鏡エキスパート
ホンベル ブルーノ(Bruno Humbel)
専門分野:電子顕微鏡
茨城大学大学院理工学研究科 教授
大友 征宇(Seiu Otomo)
専門分野:構造生物化学