重点リサーチセンター
次世代型VLPワクチン
研究開発センター
Research Center for Development of Recombinant VLP Vaccines
研究内容
(1)RSウイルスワクチン開発
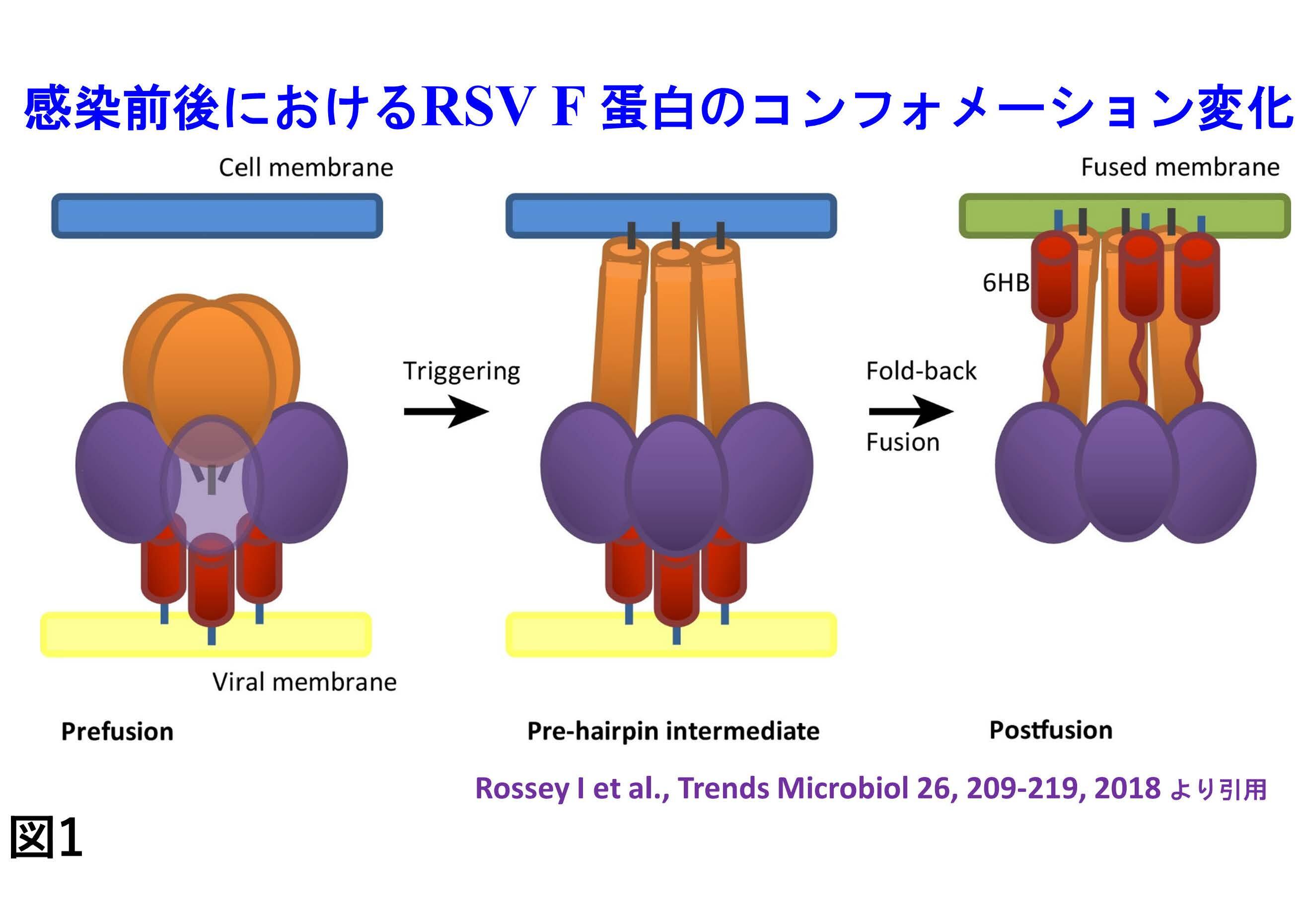
RSウイルスの感染前後での立体構造の変化(図1)による抗体生成回避機構に対応するためには、
①大型抗原運搬技術
②立体構造維持安定化F抗原の創出
が必要である。
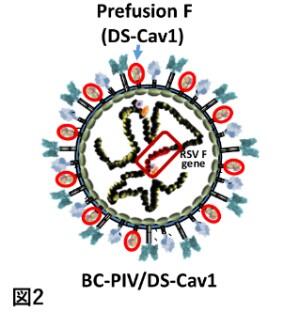
①に関して、我々はレトロウイルスベクターの約100倍の遺伝子発現能を持つ非増殖性細胞質型RNAウイルスベクターBC-PIVを開発した。BC-PIVは
1)外来遺伝子と共に外来大型蛋白をBC-PIV膜上に天然の立体構造維持状態で搭載可能
2)経鼻、筋肉内、皮内投与が可能
3) 経鼻投与で高い血清中和抗体の誘導が可能
4) 繰り返し投与(特に経鼻)可能
など優れた特性を有するので、RSウイルスワクチン開発には最適と考えられる。
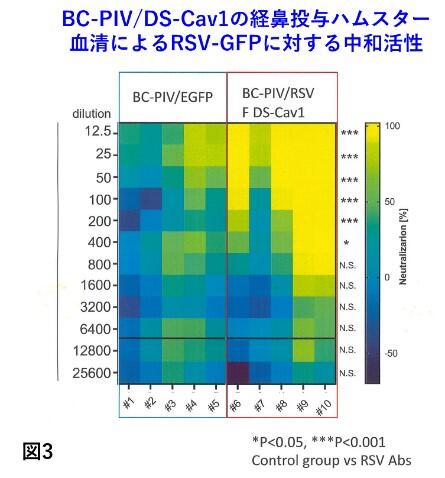
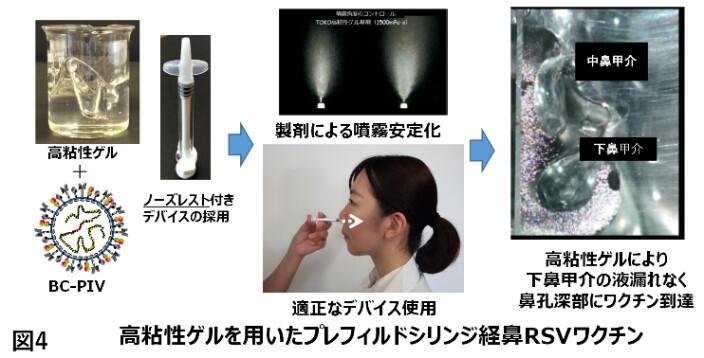
②に関しては、prefusion型安定変異F蛋白をBC-PIVに導入する(図2)ことで対応し、既にワクチン経鼻投与のハムスター血清中に高力価の中和抗体を確認(図3)した(札幌医大 小笠原徳子博士との共同研究)。乳幼児は免疫が未熟なため筋肉内投与ワクチンの効果は成人に比べて劣ることが知られており、今後は経鼻型が主流になる可能性がある。我々は乳児、高齢者を対象とした経鼻RSウイルスワクチンの実用化を進める(図4)。
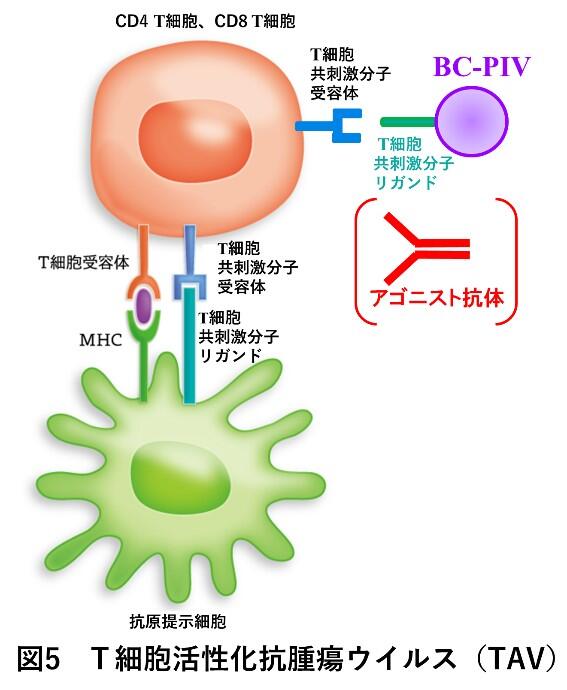
(2)T細胞活性化抗腫瘍ウイルス(TAV)開発
我々は、独自開発したプラットフォーム技術を用いて、T細胞共刺激分子リガンドを細胞膜上ではなく、ウイルス膜上に膜貫通蛋白として3量体で搭載させ、ウイルスベクターとして腫瘍局所に投与すれば、シグナル伝達性抗体を用いずとも、生理的環境に近い条件でCTLに発現しているOX40や4-1BB(受容体)を介したT細胞共刺激シグナルがオンになり、抗腫瘍細胞性免疫が賦活化されると考えた(図5)。ベクター骨格であるBC-PIV自身にアジュバント活性が内包されるので(Hara K et al., Hum Gene Ther 24: 683-691, 2013)、理論的にはCpG等のアジュバントの投与も必要ないことが予想される。我々はT細胞シグナルにおける「アクセル増強」を担う、抗腫瘍ウイルスをT cell-signaling anti-tumor virus(TAV)と名付けた。TAVの概念は国内外で全く報告されておらず、また、リガンドを2種類搭載したBC-PIV/ GITRL-OX40Lは独自の発明であり、基本骨格からも安全面の懸念が少なく、動物実験では驚異的効果がある上に、製剤化された場合の価格面でも医療経済的に優しいことが期待される。したがって、現在、オプジーボ、キートルーダ等の「ブレーキ解除」薬が効かないがん患者の福音となりうる可能性を秘めた価値ある基礎・応用研究と考えられる。