リサーチセンターResearch Center
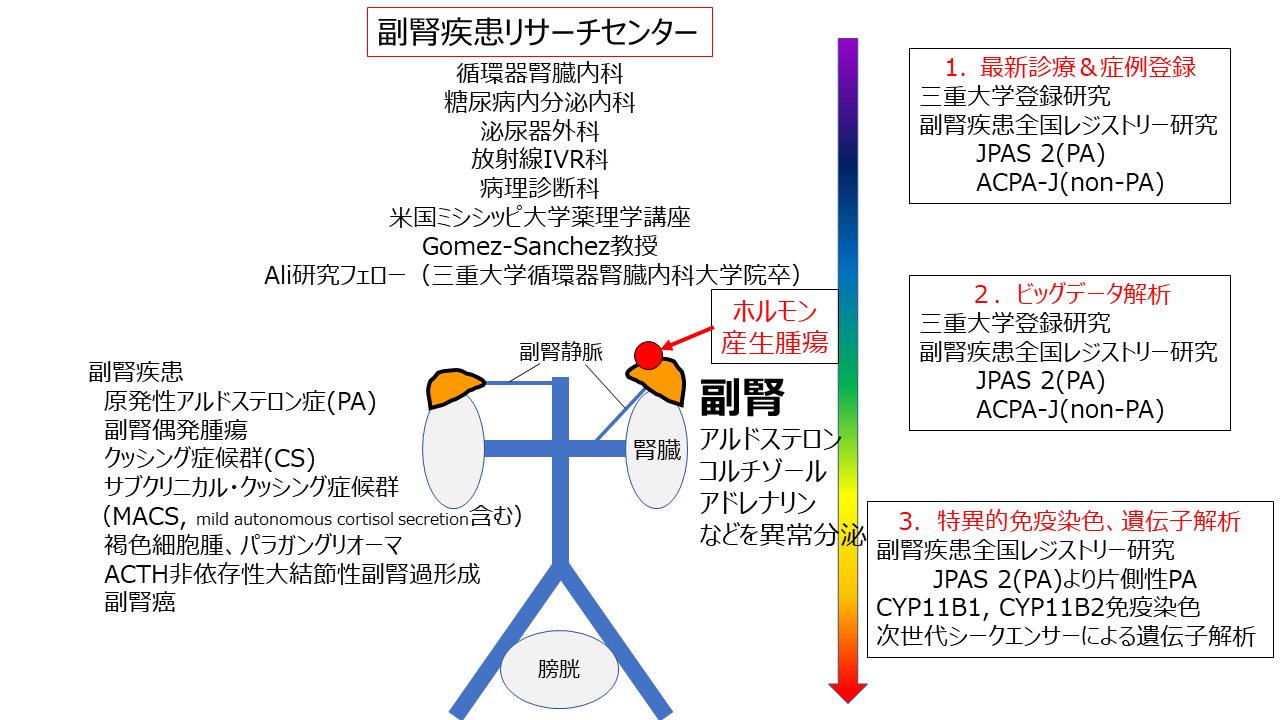
三重大学 副腎疾患リサーチセンター
研究概要
研究の背景・目的
原発性アルドステロン症(PA)は、2次性高血圧症の5-10%を占め、患者数500万人以上の副腎の最多疾患である。ガイドラインの整備に伴い、腫瘍を伴わない両側性の患者が多いことが明らかとなった。PAは通常の高血圧とは第1選択薬が異なるので、正確な診断と治療が重要である。診断には、1次スクリーニング、ホルモン負荷検査、副腎静脈サンプリング(AVS)が必要である。三重大学病院ではリアルタイムでコルチゾール測定を行い、ほぼ100%の成功率でAVSを施行出来る。2018年より全国副腎疾患レジストリーの県内唯一のセンターとして参加し、本院で診療を行った副腎疾患のPA、クッシング症候群(CS)、サブクリニカルCS、褐色細胞腫、偶発腫瘍等は全例登録され、これまで多くの日本人の診療エビデンスを報告してきた。
副腎疾患は一般の方々の理解は希薄であり、教育セミナーを行う意義は大きい。また現在の医師は原発性アルドステロン症(PA)の重要性を理解していない医師も多く、漫然と血圧コントロールを行っているのが現状である。
本センターは、通常とは逆のアプローチ、即ち一般の方のみならず、多くが見逃し、怠惰な医療イナーシャを行っている現状を医療従事自身に啓発し、行動に結びつけることを最大の目的としている。
常に頻度の高い疾患であるPAおよびMACSをきちんと診断し、治療介入することで飛躍的に三重県民の心血管イベント、フレイルを抑制し、人生100年時代の未来社会に貢献することを目指す。
研究内容
1.全国JPAS2研究(PA)およびACPA-J研究(non-PA)への症例登録、偶発腫瘍の重点スクリーニング
対象となる副腎疾患(原発性アルドステロン症、褐色細胞腫・パラガングリオーマ、クッシング症候群(CS)・サブクリニカルクッシング症候群(サブクリニカルCS)、ACTH非依存性大結節性副腎過形成など)の患者全例のデータを全国研究に登録し、診療に直結するエビデンスを創出する。
最近CTで偶然発見される副腎偶発腫瘍のうち30-50%がコルチゾールの過剰分泌を伴うMACS(mild autonomous cortisol secretion)と呼ばれる、内分泌疾患であることが判明している。MACSはサブクリニカルCSの1種であり、コルチゾールの異常分泌を通じて、糖質・鉱質コルチコイド受容体をそれぞれ活性化し、高血圧、2型糖尿病、肥満症、高脂血症、骨粗鬆症、心臓病、心房細動、慢性腎臓病、筋力低下によるフレイルを助長することが判明している(図1)。MACSの診断には、少量デキサメタゾン抑制試験が必須であり、当院として放射線科と連携し、偶発腫瘍が見つかった患者に連絡を行い、本リサーチセンターに必ず受診して頂くよう、進めていく方針である。
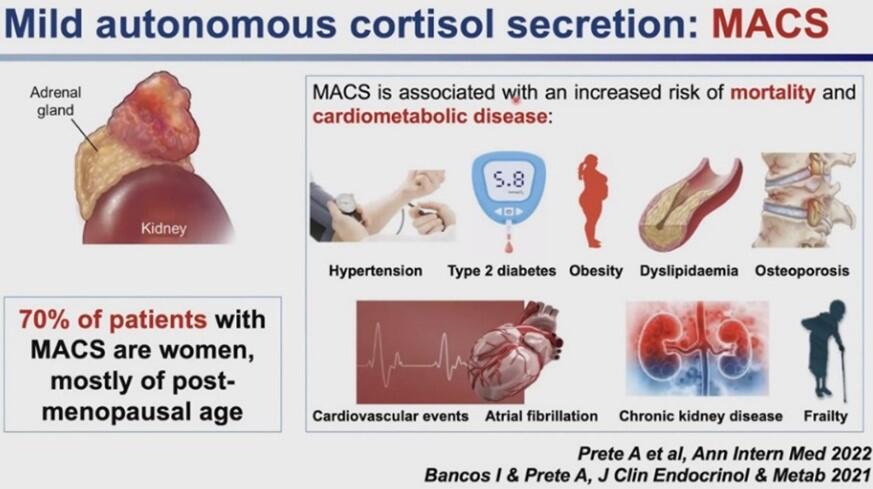 図1
図12.三重大学登録研究および全国JPAS2登録研究のデータ解析
代表者は2015年より2次性高血圧症の登録研究を行い、三重県のPAの1次スクリーニング陽性102例を解析し、80%が両側性で、副腎腫瘍を伴う場合でも両側性が多く、生食負荷試験のアルドステロン値が片側性の最も優れた独立規定因子であることを報告した。現在登録症例は約400例に到っており、その予後規定因子を検討している。さらに基礎研究でもミネラルコルチコイド受容体(MR)に着目し、MR性高血圧による心不全の発症メカニズムについて検討を行っている。
代表者らは、全国登録研究のAMED研究「難治性副腎疾患の診療に直結するエビデンス創出」(代表者:京都医療センター 成瀬光栄先生より聖マリアンナ医科大学曽根正勝教授JPAS2研究に移行)に参加しており、種々の臨床エビデンスを報告してきた。
また、分担研究として、心房細動合併のPA例の解析を行った。代表者は2021年度日本循環器学会のプレナリーセッション「Big Dataによる新たなevidence」のシンポジストとして「心房細動はPA患者の心血管イベントの独立した予測因子である」を報告した(図2)。
さらにPA治療後は、同じ心房細動合併患者でも、本態高血圧患者よりも、心血管イベントが減少することを発見し、報告した(J Hum Hypertens, 2023)。
新規の研究テーマとして、「APA症例におけるAPCCの合併」、「PAと精神疾患」、「PAと大動脈疾患」を予定している。PAは高血圧症の5-10%を占め、患者数は500万人以上であるが大部分が見過ごされており、積極的なスクリーニングが重要である。高血圧は脳卒中、心筋梗塞、心不全、心房細動の最大のリスク因子であるが、PAはその高血圧に対して、それぞれ、1.7-3.5倍にさらに発症を助長することが明らかとなっている(図3)。片側性の根治と、両側性の第一選択薬のミネラルコルチコイド受容体拮抗薬の投与が重要である。
 図2
図2 図3
図3
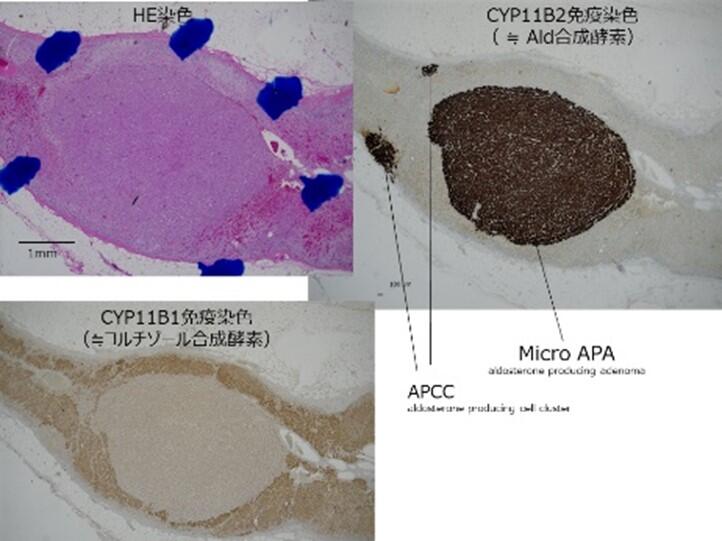
3.全国のAPA(アルドステロン産生腺腫)組織を用いた、次世代シークエンサーによる変異チャネルの同定およびAPCC(アルドステロン産生細胞クラスター)合併率の検討
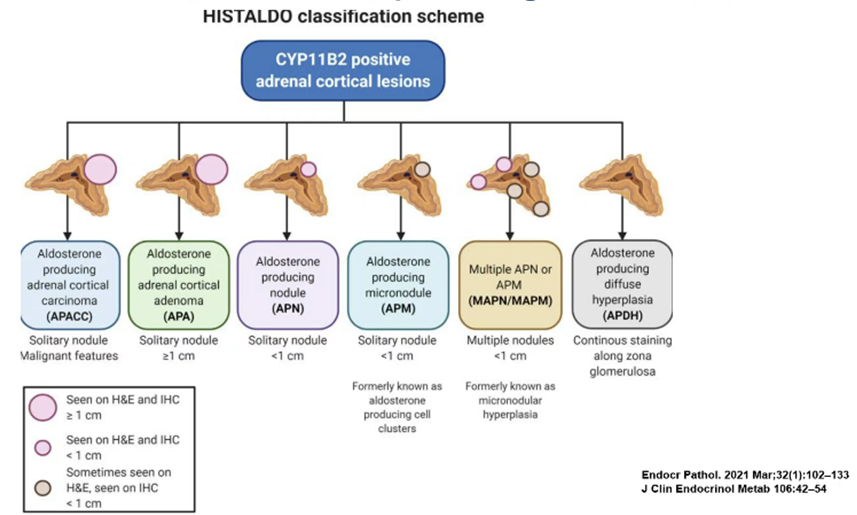
アルドステロン産生腺腫(APA)の発生のメカニズムは明らかではなく、現在の仮説として、アルドステロン産生細胞の細胞クラスター(APCC or マイクロ結節(APM))が徐々に増大し、APAを形成するのではないかと考えられている(図4)。JPAS2研究施設から提出可能な副腎組織を用いて、免疫染色を行い、その関係を明らかとする。
三重大学は副腎疾患の大家である、ミシシッピ大学薬理学講座のGomez-Sanchez教授およびAli先生との共同研究にて、アルドステロン合成酵素CYP11B2およびコルチゾール合成酵素CYP11B1の特異的モノクローナル抗体を取得している。この2つの酵素は、アミノ酸が6つ異なるのみでしかもそれぞれが1アミノ酸ずつ分離しており、分離できる抗体の開発が不可能とされていたが、立体構造の解析に基づいた特殊な方法を用いて、Gomez-Sanchez教授が特許開発したものである。実際この抗体を当院が用いることで、CYP11B2産生細胞とCYP11B1産生細胞を区別出来、APAに合併しているAPCCの有無の判断が可能となり、各症例の臨床経過と照らし合わせることで、合同検討会で情報共有を行っている(図5)。
またAPAの発生は主に種々のチャネル(KCNJ5, CACNA1D, ATP1A1等)の体細胞変異が主因となる場合も多く、その関連についても次世代シークエンサーを用いてAPA部およびAPCC部からも遺伝子解析を行う。